作者:
钱童心
国家药品监督管理局官网显示,康方生物全球首创双特异性抗体新药依沃西新适应症获批上市,单药用于 PD-L1 表达阳性的局部晚期或转移性非小细胞肺癌 (NSCLC) 的一线治疗。
依沃西的数据是今年医药行业最受关注的数据之一。康方生物称,依沃西一线治疗 PD-L1 阳性 NSCLC 新适应症的获批上市,是基于依沃西 「头对头」 默沙东帕博利珠单抗 (K 药) 的随机、双盲、对照 III 期临床研究 HARMONi-2 中获得的显著的阳性结果,包括中位无进展生存期 (PFS) 及总生存期 (OS) 的期中分析数据。
作为全球目前最畅销的抗癌药物,K 药 2024 年全球销售额达到 295 亿美元,被称为 「全球药王」。
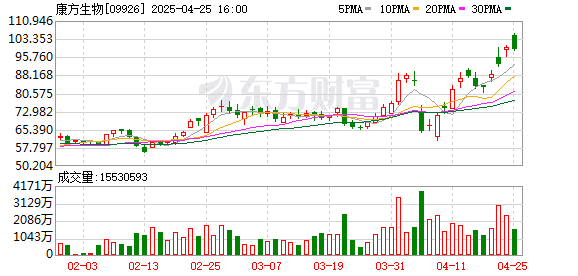
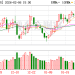
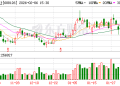
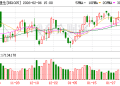
高盛在近期的报告中预测,如果依沃西能在多个适应症上取得成功,有望重塑超 900 亿美元免疫检查点肿瘤药市场格局,意味着未来几年可能会成为全球 「新药王」。过去一个月,康方生物股价上涨超过 50%。
然而,在依沃西新适应症获批的同时,康方生物的美国合作方 Summit Therapeutics 公司周五股价暴跌超过 36%。Summit 公司此前与康方生物达成了总价值高达 50 亿美元的交易,获得了依沃西在美国、欧洲、加拿大和日本等市场的权利。
针对 Summit 股价的暴跌,市场有不同的猜测。有分析认为,Summit 股价在本周早些时候大幅上涨后遭遇大幅抛售,可能是由于投资人转手买入康方生物所致,因为仅康方生物拥有依沃西在中国的权利,这将使得该公司早于 Summit 从该药物中获得收入和利润。
也有投资人预计,依沃西要在美国等市场获批可能仍需要等待较为漫长的时间,因为美国监管机构还需要对更多数据进行分析。
「从目前已经公布的数据来看,尽管中位无进展生存期 (PFS) 数据具有疗效优势,但总生存期数据 (OS) 并不具有统计学显著性,抛售的可能是那些认为这些 OS 的期中数据不足以使得该药物最终获得美国批准的投资人。」 一位生物医药投资人对第一财经记者表示。
上述人士解释称,总生存期 (OS) 是指患者用药后能存活的时间,对于美国 FDA 来说,该指标是癌症治疗的最终审批标准;而无进展生存期 (PFS),是指用药后肿瘤得到控制的时间——通常指患者进展到接受其他治疗方案的时间。许多根据 PFS 的数据获得批准的药物,但后来由于 OS 评估的结果不佳,最终可能被 FDA 撤销批准。
花旗分析师发表的最新报告观点指出,依沃西新适应症将在未来几日内在中国可用,但并不会包含 OS 曲线。「我们认为 OS 曲线可能要等今年秋季的医学会议上发表;第二次 OS 数据的中期分析可能要等到 2025 年底或 2026 年初才会发生。」 花旗报告称。
(第一财经)
文章转载自东方财富