作者:
李潇潇
GLP-1(胰高血糖素样肽-1) 减肥药的适应证天花板被进一步打开,也将这一热门赛道的竞争卷到了脂肪肝领域。
当地时间 8 月 15 日,诺和诺德对外宣布,减重版司美格鲁肽 (Wegovy) 的补充新药申请 (sNDA) 获美国食品药品监督管理局 (FDA) 批准,用于结合减少卡路里饮食和增加体力活动治疗伴有中晚期肝纤维化 (F2 期或 F3 期) 的代谢功能障碍相关性脂肪性肝炎 (MASH) 患者。
诺和诺德相关负责人指出,这是第一个也是目前唯一一个被批准用于治疗 MASH 的 GLP-1 药物。
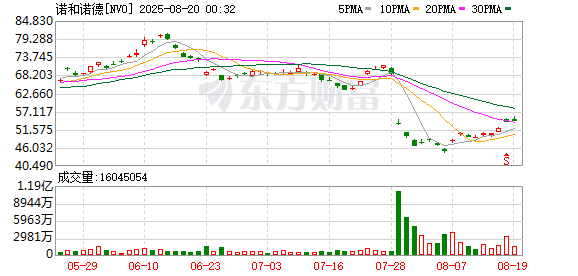
司美格鲁肽是诺和诺德的明星品种,2025 年上半年全球收入 165 亿美元,有望成为 2025 年全球医药行业的新 「药王」。此前,司美格鲁肽已经获批用于二型糖尿病、减重、心血管等疾病领域。如今,脂肪肝相关适应证获批进一步打开司美格鲁肽的适用人群,提升这一明星品种的业绩表现。澎湃新闻记者了解到,在国内,司美格鲁肽注射液用于 MASH 治疗的三期临床试验正在开展中。
MASH 是一种由肝脏中脂肪堆积引起的慢性进行性肝病,也是代谢功能障碍相关脂肪性肝病 (MASLD) 中一种更为严重的类型。在超重或肥胖人群中,约三分之一同时患有 MASH。脂肪在肝脏的长期积聚会导致肝脏炎症和严重纤维化,大约 20% 的 MASH 病例会进展为肝硬化,甚至肝癌。今年 7 月,《柳叶刀》 发布的 《全球肝癌防治策略和行动计划》 预测,至 2050 年,由 MASH 引发的肝癌病例占比增幅可达 35%。
据弗若斯特沙利文报告预计,2030 年全球 MASH 患病人数将达到 4.9 亿人,全球 MASH 药物市场将达到 322 亿美元。由于 MASH 的发病机制复杂,这一疾病领域是不少药企研发的 「黑洞」,全球范围内特效治疗药物十分有限。2024 年 3 月,FDA 曾批准口服小分子药物 Rezdiffra,用于治疗伴有中度至晚期肝瘢痕形成 (纤维化) 的 MASH 成人患者,配合饮食、运动一起使用,成为 40 年来首款获 FDA 批准上市的 MASH 药物。
GLP-1 受体分布广泛,其中就包括肝脏,GLP-1 药物在治疗 MASH 方面的潜力也一直备受期待。此次司美格鲁肽获批主要是基于 ESSENCE 试验的第一部分结果。结果显示,在第 72 周时,第一个主要终点数据显示,接受司美格鲁肽治疗的患者中,62.9% 达到脂肪性肝炎缓解且肝纤维化未恶化,而安慰剂组为 34.3%。两组间应答患者比例的估计差值 (EDP) 为 28.7%。第二个主要终点显示,司美格鲁肽治疗组有 36.8% 的患者肝纤维化得到改善且脂肪性肝炎未恶化,而安慰剂组为 22.4%。
除了诺和诺德,更多药企也在推动 GLP-1 药物治疗 MASH 的研发,且以多靶点药物为主,部分已进入三期临床阶段。随着未来更多 GLP-1 药物有 MASH 相关研究数据公布或适应证获批,GLP-1 药物的市场竞争也将开辟全新的战场。
2024 年 6 月,礼来曾在欧洲肝病学会 (EASL) 年会公布了旗下葡萄糖依赖性促胰岛素多肽 (GIP)/ GLP-1 受体激动剂替尔泊肽治疗 MASH 的二期临床试验的积极结果。研究结果显示,与安慰剂相比,73.3% 接受最高剂量替尔泊肽治疗患者实现 MASH 消退且肝纤维化未恶化这一主要终点,且过半患者产生≥1 级肝纤维化显著改善。
此外,勃林格殷格翰在 2025 年 5 月也对外宣布,GCG/GLP-1 激动剂 survodutide 针对 MASH 的两项全球大型三期临床试验在中国正式启动,两项试验旨在分别评估 survodutide 对 MASH 伴有肝纤维化 2 期或 3 期成人患者,以及代偿性 MASH 肝硬化 (4 期) 成人患者的有效性和安全性。其中,首次在中国 MASH 代偿性肝硬化 (4 期) 人群中开展的大型国际多中心三期临床试验 LIVERAGE-Cirrhosis 已成功入组首例中国受试者。
国内药企对自家 GLP-1 药物在与脂肪肝相关的疗效上也信心满满。今年 6 月,信达生物(1801.HK) 的 GCG/GLP-1 双受体激动减重药物玛仕度肽在国内获批用于成人肥胖或超重患者的长期体重控制。虽然并未获批脂肪肝相关适应证,但信达生物在研究数据中强调,可降低肝脏脂肪含量超 80%。信达生物相关负责人此前也指出,相较于 GLP-1 单受体激动剂药物,激动 GCG 受体可促进脂肪分解和脂肪酸氧化,并带来一系列代谢综合获益。
更多药企 GLP-1 药物的脂肪性肝炎尚处于研发阶段,如华东医药(000963) 的 GLP-1/GIP 双靶点长效多肽类激动剂 HDM1005 注射液的 MASH 适应证已获批新药临床试验;乐普医疗(300003) 控股的上海民为生物技术有限公司在今年 1 月宣布,收到 FDA 确认,GLP-1/GIP/FGF21 三靶点药物 MWN105 注射液临床试验申请已获得美国 FDA 批准,可在美国开展一期临床试验,适应症为 MASH。
此外,众生药业(002317) 的 GLP-1/GIP/GCG 三靶点在研药物也在开发治疗非酒精性脂肪性肝炎,目前尚处于临床前研究阶段;博瑞医药(688166) 拥有 GLP-1/GIP 受体双重激动剂 BGM0504 注射液,该公司在 2024 年财报提到,该药可激动 GIP 和 GLP-1 下游通路,产生控制血糖、减重和治疗非酒精性脂肪性肝炎 (NASH) 等生物学效应,展现多种代谢疾病治疗潜力。

(澎湃新闻)
文章转载自东方财富