作者:
李潇潇
在国产创新药对外授权热潮之下,「生长激素茅」 长春高新的子公司金赛药业选择引入海外产品,进入脱敏治疗赛道。
9 月 17 日晚间,长春高新(000661.SZ) 公告称,控股子公司长春金赛药业有限责任公司 (简称 「金赛药业」) 与丹麦制药公司 ALK 达成变应原特异性免疫治疗(AIT) 产品合作,将在中国联合开发并商业化 ALK 的屋尘螨变应原特异性免疫治疗产品,并获得 ALK 自主开发的 3 款产品在中国大陆范围内的独家代理权益。
根据协议,金赛药业将支付首付款 3270 万欧元,获得 3 款产品在中国大陆地区的商业化权益。针对尘螨变应原舌下片成人、青少年及儿童适应证在中国区域内药品监管部门的临床试验监管审批进展,金赛药业将后续支付注册里程碑付款 4000 万欧元;金赛药业将承担未来绝大部分的成人、青少年适应证三期桥接临床研究和注册费用,双方将各自承担儿童适应证的临床研究和注册费用的 50%。未来,根据上述产品在中国市场的销售情况,金赛或将后续支付销售里程碑 1.05 亿欧元;金赛药业将承担上述产品的市场推广及销售相关成本,ALK 将负责上述产品的生产与供应。
按照上述数据来计算,金赛药业在此次交易中最高需要支付金额达到 1.78 亿欧元,按当前汇率约合 15 亿元人民币。2025 年半年报显示,长春高新期末现金及现金等价物余额为 42.99 亿元。长春高新在 17 日晚间的公告中强调,该协议中所约定的里程碑款需要满足一定的条件,最终支付的里程碑付款金额尚存在不确定性。
金赛药业此前最为外界熟知的业务是生长激素产品,也是靠着这类产品,金赛药业一直是长春高新业绩的关键支撑。2025 年半年报显示,长春高新实现营业收入 66.03 亿元,其中金赛药业实现收入 54.69 亿元,营收贡献率超过 82%。近几年,由于集采等因素的影响,生长激素的发展也面临瓶颈。此次进入脱敏治疗赛道,可以视为长春高新寻找生长激素之外增长点的动作。
长春高新集团总经理,金赛药业创始人总经理、首席科学家金磊在签约仪式上表示:「此次战略合作是 ALK 深耕中国脱敏治疗市场的重要里程碑,也是金赛药业丰富多元产品布局的关键举措。脱敏治疗产品将与公司现有产品组合及研发管线形成强大的战略协同效应,增强公司在该领域的整体竞争力。」
到底什么样的合作方和产品,让长春高新以及金赛药业愿意重金引入?
此次金赛药业牵手的丹麦上市药企 ALK 是全球最大的脱敏治疗公司,总部位于丹麦霍尔肖姆,在全球拥有约 2800 名员工,全球市占率超 45%。ALK 首席执行官彼得·哈林 (Peter Halling) 表示:「通过本次合作,我们坚信将显著提高脱敏治疗产品系列在中国的市场渗透率。」
根据双方合作条款,金赛药业将获得 ALK 皮下注射用屋尘螨变应原制剂 (安脱达)、螨变应原皮肤点刺试剂盒 (安刺) 及尘螨变应原舌下片 (ACARIZAX) 在中国大陆的独家权益,合作权益期限至 2039 年 12 月 31 日止。此外,金赛药业将自 2025 年 10 月 1 日起接手 ALK 在中国大陆已上市合作产品的销售与市场推广工作,并由双方合作完成目前正在进行的尘螨变应原舌下片的临床开发工作,同时推动其尽快获得成人、青少年适应证的批准,并在尘螨变应原舌下片获得药品监管机构批准后,负责其在合作区域内的销售及市场推广。
具体来看,屋尘螨变应原制剂 (安脱达)、螨变应原皮肤点刺试剂盒 (安刺) 已经在中国上市,而尘螨变应原舌下片是全球首款被批准用于过敏性哮喘和过敏性鼻炎的舌下免疫治疗片剂,已获得欧洲、美国、俄罗斯、澳大利亚、日本、新加坡、韩国,以及中国香港、中国台湾等多个国家和地区监管机构获批上市。目前已在中国大湾区和海南博鳌乐城医疗先行区应用,并同步正在中国开展三期桥接注册研究。
据 Fortune Business Insights 报告,全球过敏免疫治疗市场规模预计到 2030 年将达到 32 亿美元,复合年增长率为 9.5%。中国拥有全球尘螨过敏患者最大的患者人群,但中国过敏免疫疗法市场开发不足、缺乏创新产品。目前接受脱敏治疗的患者数量不足 100 万,存在大量未满足临床需求。
脱敏治疗是针对 IgE 介导的一型变态反应性疾病的对因治疗,诱导机体免疫耐受,使患者再次接触相应过敏原时症状明显减轻,或甚至不产生临床症状,被公认为是唯一可能改变过敏性疾病自然进程的对因治疗方法。
儿童是过敏疾病的高发人群之一,而这一群体也是金赛药业此前生长激素产品瞄准的受众。长春高新在公告中特别提到,本次合作产品将与金赛药业儿科业务形成深度产品协同,助力其在生长激素核心领域之外,进一步构筑儿科新领域的竞争优势。
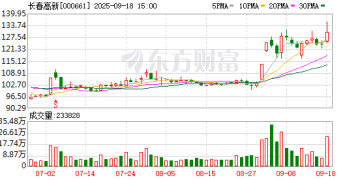
9 月 17 日收盘,长春高新报收 123.88 元/股,涨 0.02%,市值 505.35 亿元。

(澎湃新闻)
文章转载自东方财富